ATP lasertherapie
Het gebruik van lasertherapie (LLLT) met deze 3 nieuwe kleuren is een opwindende ontwikkeling voor de behandeling van mitochondriale disfunctie.
Wanneer het laserlicht golflengten uit de rood-groen-violette delen van het spectrum bevat, worden alle fasen van het mitochondriale energieopwekkingsproces gestimuleerd.
Hoe mitochondriën energie maken
Elke cel in het lichaam – behalve de rode bloedcellen – bevat veel mitochondriën. Deze kleine krachtpatsers genereren cellulaire energie via adenosinetrifosfaat (ATP), dat bijna alle essentiële functies van het lichaam aandrijft. Cellen die meer energie nodig hebben, zoals die in het hart, de lever, de spieren en de hersenen, bevatten meer mitochondriën. Levercellen bevatten één tot 2.000 mitochondriën per cel; elke hartcel bevat ongeveer 5.000 mitochondriën. Naast de intracellulaire mitochondriën circuleren vrij zwevende mitochondriën in de bloedbaan.Het proces van het omzetten van glucose in ATP vindt plaats in het gevouwen binnenmembraan van elke mitochondrion. Het begint wanneer glucose uit de cel de mitochondriën binnendringt via het buitenmembraan van de structuur. De glucose wordt vervolgens in de mitochondriale matrix door de citroenzuurcyclus (de Krebs-cyclus) gemetaboliseerd tot afbraakproducten (voornamelijk pyruvaat). Deze producten gaan vervolgens naar het binnenmembraan van het mitochondrion en het proces van het omzetten ervan in ATP begint.
Via een reeks redoxreacties worden de voedingsstoffen langs een elektronentransportketen (ETC) door vijf eiwitcomponenten verplaatst. In elk van de eerste vier fasen van de keten produceert het proces vrije energie die uiteindelijk de fosforylering van adenosinedifosfaat (ADP) naar ATP in het vijfde en laatste complex van de keten, ATP-synthase, aandrijft.
Uiteindelijk is één glucosemolecuul omgezet in 36 tot 38 moleculen ATP, samen met koolstofdioxide en water als bijproducten.
Mitochondriale disfunctie: verstoring van de energieproductie
Wanneer de energieproductie in de mitochondriën soepel verloopt, beschikt het lichaam over voldoende energie voor normale functies, groei en aanpassing. Wanneer het proces echter wordt verstoord, ontstaat er een mitochondriale disfunctie. Het energieniveau daalt, de oxidatieve stress neemt toe, de celsignalering wordt verstoord en er treedt ontsteking op. De verlaagde ATP-niveaus kunnen leiden tot vermoeidheid, overgevoeligheid en chronische pijn. Chronisch verminderde mitochondriale functie kan zelfs leiden tot fataal orgaanfalen.
Mitochondriale disfunctie treedt op wanneer de mitochondriën niet efficiënt werken. Fundamentele oorzaken van mitochondriale disfunctie zijn onder meer:
Oxidatieve stress. De energieproductie in de mitochondriën genereert hoge niveaus van vrije radicalen, met name reactieve zuurstofsoorten (ROS), die de antioxidantniveaus kunnen overstijgen, wat kan leiden tot schade door oxidatieve stress, verminderde werking en ontstekingen.
Virale ziekte.
Mitochondriale disfunctie veroorzaakt door virale ziekten is een belangrijke onderliggende oorzaak van chronische ziekten, waaronder langdurige COVID en chronische EBV (Epstein Barr-infectie). Ook is bewezen dat chronische Candida- en Lyme-ziekte een belangrijke oorzaak zijn van mitochondriale disfunctie, vooral in de darmen, lever en hart.
Micro-organismen.
In het algemeen kunnen micro-organismen de delicate interne structuren van de mitochondriën beschadigen en leiden tot een verhoogde productie van vrije radicalen en de waterval van schade die dit veroorzaakt. De mitochondriën kunnen niet langer efficiënt energie produceren, wat leidt tot chronische en vaak ernstige vermoeidheid.
Omgevingsfactoren.
Blootstelling aan milieutoxines, zoals zware metalen, pesticiden en bepaalde medicijnen, kan de integriteit van de buitenste en binnenste mitochondriale membranen verstoren. Ze kunnen ook de enzymactiviteit verstoren en de replicatie- en reparatiemechanismen van mitochondriaal DNA beschadigen. Standaard vrij verkrijgbare en voorgeschreven niet-steroïde anti-inflammatoire geneesmiddelen, waaronder aspirine, ibuprofen, indomethacine en diclofenac, kunnen de elektronentransportketen remmen en de mitochondriale functie aantasten.
Leeftijdsgebonden veranderingen.
De algehele mitochondriale functie neemt af met de leeftijd, deels als gevolg van de opgebouwde schade door oxidatieve stress en de verminderde efficiëntie van reparatiemechanismen. Leeftijdsgebonden mitochondriale disfunctie draagt bij aan leeftijdsgebonden ziekten en verslechtert de algehele cellulaire functie.
Sedentaire levensstijl.
Gebrek aan fysieke activiteit leidt tot een lagere productie van oxidatieve enzymen, meer schade door vrije radicalen en verminderde activiteit van de elektronentransportketen.
Metabolische stoornissen. Prediabetes, diabetes, obesitas en metabool syndroom kunnen de mitochondriale functie aantasten door de afbraak van glucose te verstoren, de mitochondriale membranen te beschadigen en de oxidatieve stress en schade door vrije radicalen te vergroten.
Reactie op celgevaar.
Wanneer de mitochondriën disfunctioneel worden door leeftijd, levensstijl en stofwisselingsstoornissen, werken alle systemen in het lichaam, inclusief het immuunsysteem, op suboptimale niveaus. Een slechte levensstijl die leidt tot een suboptimale mitochondriale functie leidt ook tot chronische ontstekingen op laag niveau, wat verdere mitochondriale disfunctie en een zichzelf in stand houdende circel van vermoeidheid en extra schade veroorzaakt. Als een onstekingsziekte zoals COVID, EBV, Lyme of Candida wordt toegevoegd aan het toch al disfunctionele systeem, is het immuunsysteem minder toegerust om dit te bestrijden en ontstaan chronische ziektebeelden. De artsen staan dan klaar met hun symptoom onderdrukkende medicijnen. Die zeker helpen, maar de zojuist genoemde oorzaak absoluut niet genezen.
Wanneer ziekte toeslaat, gaan de mitochondriën in de celgevaarreactie (CDR)-modus. CDR wordt gedefinieerd als “de evolutionair geconserveerde metabolische respons die cellen en gastheren tegen schade beschermt. Het wordt veroorzaakt door ontmoetingen met chemische, fysieke of biologische bedreigingen die de cellulaire capaciteit voor homeostase te boven gaan.
Bij CDR schakelt de mitochondriale activiteit over van energieproductie naar celverdediging in de cel om het immuunsysteem te ondersteunen. Met andere woorden, de mitochondriën downreguleren en leiden hun energie af naar het immuunsysteem.
Wanneer de mitochondriën overschakelen naar cellulaire energieproductie die de immuunafweer bevordert, blijft er weinig energie over voor andere functies. Dit is de onderliggende oorzaak van vermoeidheid die gewoonlijk met elke ziekte gepaard gaat. Gezonde mitochondriën hebben voldoende reserve om tijdens een ziekte energie te blijven genereren, zij het op een lager niveau. Wanneer de mitochondriën goed functioneren, keren de energieniveaus terug naar normaal nadat het lichaam infecties heeft bestreden.
Omdat het proces zo energetisch is, kan niet-thermisch laserlicht het stimuleren en de functie en stabiliteit van de mitochondriën verbeteren door zeer energetische fotonen van energie in de cel af te leveren. Wanneer fotonen met zichtbare lichtenergie van een niet-thermische laser bepaalde atomen in het binnenmembraan van de mitochondriën treffen, waar de elektronentransportketen plaatsvindt, zal dat de energie het elektron van dat atoom naar een hoger energieniveau duwen, waar een elektronenacceptor in de elektronentransportketen kan het oppakken.
Er wordt aangenomen dat fotonen in het zichtbare laserlichtspectrum de complexen I, II, III en IV van de elektronentransportketen beïnvloeden. Sommige golflengten die worden gebruikt bij lasertherapie op laag niveau zijn bijzonder effectief op verschillende punten in de elektronentransportketen. Het gebruik van de juiste golflengten is van cruciaal belang voor het bereiken van een uitstekende therapeutische respons.
Laserlicht in het bereik van 400 tot 450 nm (optimaal = 405nm violet) stimuleert complexen I en II. Complex I is het grootste en meest gecompliceerde complex van de elektronentransportketen. De reacties hier zijn snelheidsbeperkend; elke disfunctie op dit punt zal de energieproductie beïnvloeden terwijl deze door de stroomafwaartse complexen beweegt. Lasertherapie met behulp van de violette golflengte levert voldoende fotonische energie om de benodigde elektronensprongen teweeg te brengen om de complexen I en II efficiënter te laten functioneren.
Complex III wordt gestimuleerd door laserlicht in het bereik van 500 tot 560 nm (optimaal 520nm groen). Laserlicht in dit bereik kan de processen stimuleren die verband houden met oxidatieve fosforylering bij het ATP-synthasecomplex, de laatste stap in de productie van ATP.
Complex IV wordt alleen gestimuleerd door laserlicht in het bereik van 600 tot 670 nm (optimaal 635nm rood).
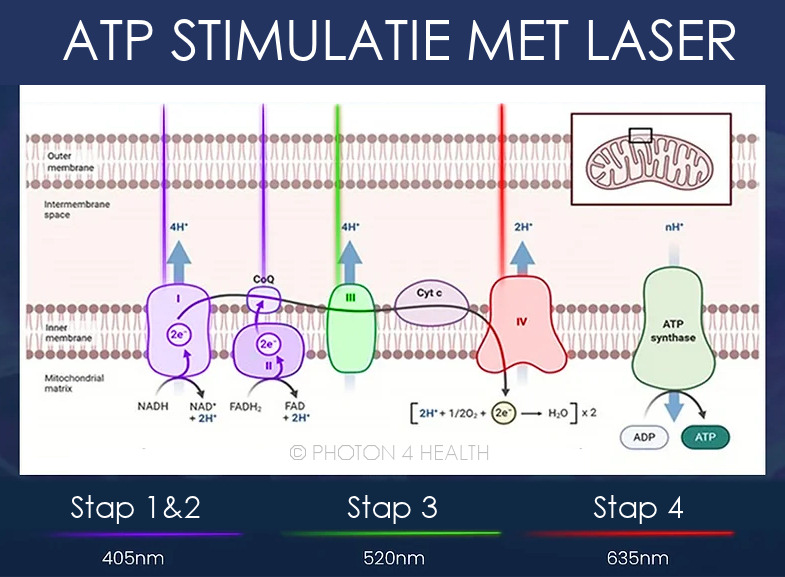
Door de activiteit van de ETC-complexen te stimuleren, wordt het snelheidsbeperkende mechanisme voor ATP hersteld en wordt de ATP-productie in de mitochondriën verhoogd. Bovendien absorberen de vrij zwevende mitochondriën in de bloedbaan fotonenenergie en verspreiden ze zich door het lichaam, waardoor fotonenenergie een systemisch effect kan hebben op plaatsen weg van de lasertoepassingsplaats.
Herstel van de mitochondriale functie met lasertherapie op laag niveau
Wanneer de mitochondriën disfunctioneel worden, kan hun normale functie vaak worden hersteld met lasertherapie op laag niveau.
Lasertherapie op laag niveau met behulp van een rood-groen-violette niet-thermische laser kan de energieproductie in de mitochondriën helpen stimuleren. Deze golflengten richten zich op de gehele elektronentransportketen van de mitochondriën, met name op de groene en violette golflengten met hoge fotonenenergie. De sleutel tot hun effectiviteit is de fotobiomische energie die de golflengten naar de cellen en hun mitochondriën zenden.
Laserlicht in de rood-groen-violette golflengten activeert fotoreceptormoleculen op elk punt langs de mitochondriale elektronenoverdrachtsketen. Het fotobiomische effect is bijzonder effectief bij het beïnvloeden van de productie van cytochroom-c-oxidase in complex IV.12 Wanneer de elektronenstroom in de mitochondriën beperkt of volledig geblokkeerd is, is het effect als een knik in een slang: er komt niets doorheen. De fotobiomodulatie-impact van rood-groen-violet laserlicht maakt de slang los en herstelt de energiestroom.
Laatste gedachten
Op bewijs gebaseerd onderzoek ondersteunt het gebruik van lasertherapie op laag niveau voor de behandeling van chronische pijn aan het bewegingsapparaat. Uit een recent onderzoek blijkt dat golflengten met hoge foto-energie in het groene en violette spectrum zeer effectief zijn bij het verminderen van chronische nek- en schouderpijn. Deze studie leverde substantiële steun voor de eerste goedkeuring van de Food and Drug Administration voor de gecombineerde toepassing van groene en violette lasers.13 Ander onderzoek suggereert dat rood-groen-violette lasertherapie nuttig kan zijn voor een reeks verschillende aandoeningen die verband houden met mitochondriale disfunctie, waaronder chronische vermoeidheid en traumatisch hersenletsel.
Referenties
- Sreedhar A, et al. Mitochondria in skin health, aging and disease. Cell Death Dis. 2020;11(6):444. PubMed. https://pubmed.ncbi.nlm.nih.gov/32518230/. Accessed Feb. 27, 2024.
- Meeus M, et al. The role of mitochondrial dysfunctions due to oxidative and nitrosative stress in chronic pain or chronic fatigue syndromes and fibromyalgia patients: peripheral and central mechanisms as therapeutic targets? Expert Opin Ther Targets. 2013;17(9):1081-1089. PubMed. https://pubmed.ncbi.nlm.nih.gov/23834645/. Accessed Feb. 27, 2024.
- Zhou B, Tian R. Mitochondrial dysfunction in pathophysiology of heart failure. J Clin Invest. 2018;128(9):3716-3726. PubMed. https://pubmed.ncbi.nlm.nih.gov/30124471/. Accessed Feb. 27, 2024.
- Kumaran S, et al. Age-associated decreased activities of mitochondrial electron transport chain complexes in heart and skeletal muscle: role of L-carnitine. Chem Biol Interact. 2004;148(1-2):11-18. PubMed. https://pubmed.ncbi.nlm.nih.gov/15223352/. Accessed Feb. 27, 2024.
- Naviaux RK. Metabolic features of the cell danger response. Mitochondrion. 2014;16:7-17. PubMed. https://pubmed.ncbi.nlm.nih.gov/23981537/. Accessed Feb. 27, 2024.
- Ahmad M, et al. Biochemistry, Electron Transport Chain. In: StatPearls. Treasure Island (FL): StatPearls Publishing. September 4, 2023. PubMed. https://pubmed.ncbi.nlm.nih.gov/30252361/. Accessed Feb. 27, 2024.
- Sharma LK, Lu J, Bai Y. Mitochondrial respiratory complex I: structure, function and implication in human diseases. Curr Med Chem. 2009;16(10):1266-1277. PubMed. https://pubmed.ncbi.nlm.nih.gov/19355884/. Accessed Feb. 27, 2024.
- Du Z, et al. Structure of the human respiratory complex II. Proc Natl Acad Sci USA. 2023;120(18):e2216713120. PubMed. https://pubmed.ncbi.nlm.nih.gov/37098072/. Accessed Feb. 27, 2024.
- Kassák P, et al. Mitochondrial alterations induced by 532 nm laser irradiation. Gen Physiol Biophys. 2005;24(2):209-220. PubMed. https://pubmed.ncbi.nlm.nih.gov/16118473/. Accessed Feb. 27, 2024.
- Toledo FG, et al. Changes induced by physical activity and weight loss in the morphology of intermyofibrillar mitochondria in obese men and women. J Clin Endocrinol Metab. 2006;91(8):3224-3227. PubMed. https://pubmed.ncbi.nlm.nih.gov/16684829/. Accessed Feb. 27, 2024.
- San-Millán I. The Key Role of Mitochondrial Function in Health and Disease. Antioxidants. 2023;12(4):782. PubMed. https://pubmed.ncbi.nlm.nih.gov/37107158/. Accessed Feb. 27, 2024.
- Karu T. Mitochondrial mechanisms of photobiomodulation in context of new data about multiple roles of ATP. Photomed Laser Surg. 2010;28(2):159-160. PubMed. https://pubmed.ncbi.nlm.nih.gov/20374017/. Accessed Feb. 27, 2024.
- Sammons T, et al. Assessing the Impact of High Photon Energy Wavelengths on the Treatment of Chronic Neck and Shoulder Pain. Evid Based Complement Alternat Med. 2023;2023:6672019. PubMed. https://pubmed.ncbi.nlm.nih.gov/37829623/. Accessed Feb. 27, 2024.

Hulp nodig?
Bel ons op 0031611049629







